Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
Por otro lado, Gay-Lussac relacionó la presión y la temperatura como magnitudes directamente proporcionales en la llamada segunda ley de Gay-Lussac.
Volumen sobre temperatura: Constante (K -en referencia a si mismo)
o también:
donde:
- V es el volumen.
- T es la temperatura absoluta (es decir, medida en Kelvin).
- k2 es la constante de proporcionalidad.
Además puede expresarse como:
donde:
 = Volumen inicial
= Volumen inicial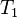 = Temperatura inicial
= Temperatura inicial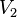 = Volumen final
= Volumen final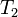 = Temperatura final
= Temperatura final
Despejando T₁ se obtiene:
Despejando T₂ se obtiene:
Despejando V₁ es igual a:
Despejando V₂ se obtiene:
Un buen experimento para demostrar esta ley es el de calentar una lata con un poco de agua, al hervir el agua se sumerge en agua fría y su volumen cambia.
Comprobación de la ley de Charles en experimento casero
Ejercicios Propuestos:
1.- Se tiene un gas a una presión constante de 560 mm de Hg, el gas ocupa un volumen de 23 cm³ a una temperatura que está en 69°C . ¿Qué volumen ocupará el gas a una temperatura de 13°C?
2.- El volumen de una muestra de oxígeno es 2.5 litros a 50°C ¿Qué volumen ocupará el gas a 25°C, si la presión permanece constante.

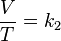
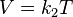
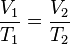

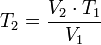
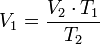

No hay comentarios:
Publicar un comentario