La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.
o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante  para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:

Esta ley es una simplificación de la ley de los gases ideales o perfectos particularizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ecuación universal de los gases.
Ejemplos resueltos de la ley de Boyle-Mariotte
Solución: Lo primero que vamos analizar para la resolución del problema, son nuestros datos, saber que tenemos y que nos hace falta.
Por lo que podemos observar el problema nos pide el volumen final es decir  , vamos a utilizar la fórmula de Boyle-Mariotte e iniciaremos a despejar la variable que necesitamos para poder iniciar a resolver el problema.
, vamos a utilizar la fórmula de Boyle-Mariotte e iniciaremos a despejar la variable que necesitamos para poder iniciar a resolver el problema.
Despejando >> 
Sustituyendo nuestros datos.
Por lo que nuestro volumen final es de  litros.
litros.
Con esto podemos concluir que mientras la presión bajó el volumen aumentó.
No es difícil analizar dichos problemas, veamos otro ejemplo.
Solución: Al igual que el problema anterior lo que necesitamos es conocer nuestros datos, sin los datos no podemos hacer absolutamente nada, ahora hagamos de nuevo un listado de nuestros datos.
Observamos que lo que nos falta es la presión final, por lo que vamos a despejar  de la fórmula.
de la fórmula.
Despejando >> 
Sustituyendo nuestros datos.
Tenemos que 1.25 atm. es la presión final de lo que nos pide nuestro problema, sin embargo el mismo problema dice que tenemos que convertir las unidades de presión, en este caso atmósferas a mm de Hg para ello haremos una regla de tres.
Si 1 atm equivale a 760 mm de Hg, 1.25 atm ¿a cuántos mm de Hg equivaldría?
1 atm ———– 760 mm de Hg
1.25 atm ———— x mm de Hg
por lo que 950 mm de Hg es la presión final obtenida en un recipiente de 3 litros.
¿Aún no quedó claro?
Aquí te dejo un vídeo explicativo de como lo he hecho con otro ejemplo similar a los anteriores.
Reforcemos nuestros conocimientos
Experimentos de la ley de boyle
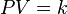
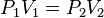




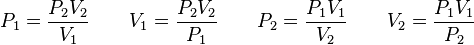

No hay comentarios:
Publicar un comentario